研究发现,在抗体驱动的炎症中,中性粒细胞并不能单独黏附免疫复合物,而是必须借助血小板。这一机制解释了类风湿关节炎等疾病中炎症持续加重的原因,也为干预自身免疫病提供了新思路。
血管受伤时,血小板的角色很清晰,止血、封堵伤口,并顺带招募中性粒细胞抵御细菌入侵。但在很多自身免疫病中,血管并没有明显破损,中性粒细胞却依然大量涌入组织,造成炎症和损伤。这一直是个难以解释的问题。
研究人员关注的核心对象是免疫复合物,也就是抗原和抗体结合形成的分子结构。在感染时,它们有助于清除病原体;但在类风湿关节炎、系统性红斑狼疮等疾病中,抗体会错误地识别自身成分,免疫复合物沉积在血管壁和组织中,反而成为炎症的源头。
理论上,中性粒细胞本身就带有可以识别抗体的受体,似乎应该能直接黏附这些免疫复合物。但研究发现,事情远没有这么简单。
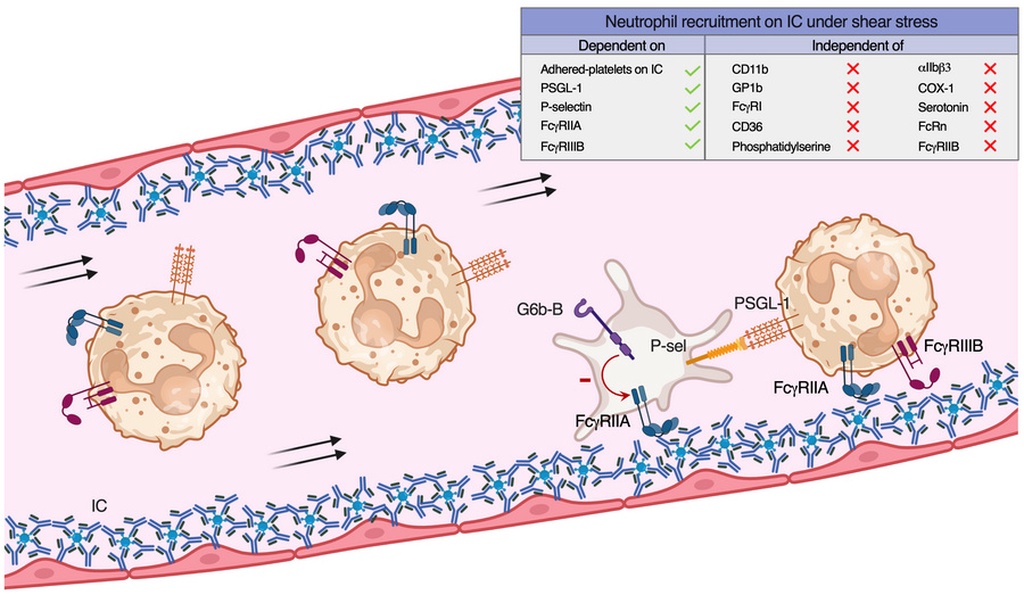
研究团队使用类风湿关节炎患者的血液细胞,并构建了一个模拟真实血流剪切力的微流控系统。他们将含有IgG的免疫复合物固定在表面,观察细胞在流动条件下的行为。结果显示,中性粒细胞即使带有Fc受体,在血流中也很难稳定地黏附在免疫复合物上,除非有血小板的参与。
关键在于血小板表达的FcγRIIA。这种受体可以与免疫复合物结合,帮助血小板牢牢“贴”在表面,抵抗血流带来的冲刷力。中性粒细胞则通过FcγRIIA和FcγRIIIB识别免疫复合物,但真正让它们被“拉住”的,是血小板与中性粒细胞之间的分子连接。
研究表明,血小板表面的P选择素与中性粒细胞上的PSGL-1结合,是中性粒细胞被招募到炎症位点的关键一步。相比之下,过去被认为很重要的整合素Mac-1,在这一过程中反而并非必需。
这一发现不仅存在于体外实验。在自身抗体介导的关节炎小鼠模型中,活体成像显示,中性粒细胞的募集同样严重依赖PSGL-1。当研究人员阻断PSGL-1时,血小板和中性粒细胞的相互作用几乎完全消失,关节炎症状也随之显著减轻。而阻断Mac-1并没有类似效果。
更重要的是,当小鼠被人为赋予人类的FcγRIIA后,关节炎明显加重,说明这种受体本身就会放大炎症反应。再次印证了血小板并非被动旁观者,而是抗体驱动炎症中的关键“放大器”。
从流体力学角度看,这种分工其实很合理。中性粒细胞体积大,在血流中更容易被推向血管中央,难以靠近血管壁。而数量极多、体积小、呈扁平圆盘状的血小板,更适合在高剪切力环境下贴近血管壁活动,像巡逻兵一样扫描异常信号。一旦它们黏附在免疫复合物上,就为中性粒细胞搭建了一个稳定的“着陆平台”。
研究还指出,单个IgG分子不足以让血小板黏附,这可能是因为FcγRIIA亲和力较低,更偏好结合成簇排列的IgG。这种特性或许正是为了避免血小板在充满抗体的血液中被持续激活。
这些发现改变了一个长期存在的看法。过去,血小板常被认为只是炎症的被动参与者,只有在组织损伤或凝血时才发挥作用。而现在的证据表明,在自身免疫病中,它们可能是最早介入的细胞之一,直接决定中性粒细胞能否在血流中停下来,进入组织,引发持续炎症。
从更广的角度看,免疫复合物并不只存在于组织中。某些药物或疫苗也可能诱导免疫复合物形成,与血小板相互作用,引发血栓和炎症反应。理解血小板与中性粒细胞之间的协作关系,有助于解释这些现象,也为靶向阻断炎症提供了新的分子入口。
这项研究最终揭示的是一种被忽视的协作机制。在抗体驱动的炎症中,血小板不是配角,而是让中性粒细胞真正“站稳脚跟”的关键条件。
