医学
当今大多数基因疗法依赖于病毒
威尔·昂格勒不是一个典型的四年级学生。
这位来自弗吉尼亚州米德洛锡安的 10 岁男孩与他的朋友们玩捉迷藏,在海里游泳。“我认为他的同伴会把他描述成一个善良、可爱、有趣、超级聪明的人,”他的母亲希拉·昂格勒说。他赢得了一个全县的公民奖,并被评为年度课堂学生。
但“他不是一个真正快的跑步者,”他的同伴可能会说。“他真的不跑步。”威尔出生时患有杜氏肌肉营养不良症,这是一种遗传性疾病,会导致全身肌肉随着时间的推移而分解。这不仅包括骨骼肌,还包括心脏和控制呼吸的膈肌。最终,这些重要的肌肉会停止正常工作,导致死亡。这种疾病是由负责肌营养不良蛋白的基因突变引起的,肌营养不良蛋白是一种充当减震器以防止肌肉在收缩时受到损坏的蛋白质。它影响了全球约 4.8/100,000 人,主要是男孩和年轻男性。美国约有 10,000 人患有杜氏肌肉营养不良症。
希拉·昂格勒说,去年威尔在一家激光标签公园庆祝了他的生日,但其他和他年龄相仿的患有杜氏肌肉营养不良症的孩子“不坐公共汽车。他们在午餐室不端自己的托盘。”
不同之处在于威尔在 5 岁时接受了实验性基因疗法。就在 2018 年圣诞节前夕,俄亥俄州哥伦布市全国儿童医院的医生给威尔输了一种病毒。这些病毒向他的肌肉传递了制造一种短形式的肌营养不良蛋白的指令。马萨诸塞州剑桥市的 Sarepta Therapeutics 的科学家,即制造这种基因疗法的公司,开发了这个名为微肌营养不良蛋白的版本,作为替代品,有望保护肌肉免受伤害。
尽管在一次随机对照试验中,该疗法与安慰剂相比没有显示出统计学意义的改善,并且尚未公布正在进行的临床试验结果以确定疗效,但威尔和 Sarepta 临床试验中的其他 83 名男孩现在制造了微肌营养不良蛋白。部分基于该证据,美国食品和药物管理局今年早些时候批准了该疗法用于 4 岁和 5 岁的儿童,第一名在获批后接受该疗法的儿童于 8 月 2 日接受了输液。
对于希拉·昂格勒来说,毫无疑问,基因疗法对威尔有效。他现在可以做一些他以前不能做的日常事情,比如轻松地爬楼梯、刷牙和自己穿衣服。他能骑自行车,在游泳队训练中游到 500 米。
输液后几个月,希拉听到威尔和他弟弟亚当说话。“我刚好在门外,他说,‘亚当,还记得我的腿总是疼吗?他们不再疼了,’”她回忆道。“那是他腿部肌肉发炎的生活经历,这些肌肉不断受到损伤。然后,这种消退对他生活的影响是无法估量的。”
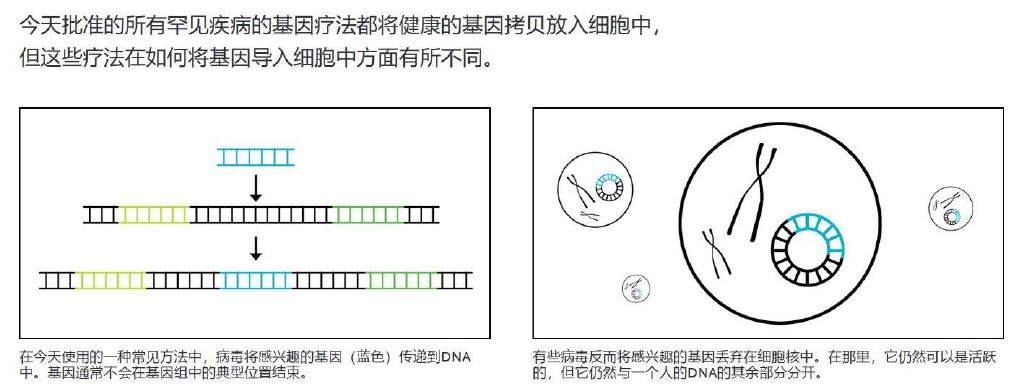
自 2017 年以来,FDA 已批准了七种其他针对罕见遗传疾病的基因疗法。每种疗法都会将一个基因的健康拷贝放入细胞中,以补偿缺失或突变的拷贝。一些使用基因编辑的罕见疾病的潜在治疗方法,一种在 DNA 水平上进行靶向改变的基因疗法,也可能很快获得批准。
根据美国基因和细胞治疗学会的数据,全世界正在开发 2,000 多种基因疗法。这个数字包括经过基因工程改造以对抗疾病的细胞,例如称为 CAR-T 细胞的免疫细胞被编程为杀死癌症或防止狼疮攻击身体 (SN: 2/2/22; SN: 9/15/22)。但与这些针对癌症和自身免疫性疾病的疗法不同——这些疗法可能治疗数百万人,使它们对制药公司具有财务吸引力——每种针对罕见疾病的基因疗法可能帮助数千名患者或更少患者。
自从 1970 年代首次提出用基因疗法治疗此类遗传疾病以来,它经历了激动人心的高潮——包括 1990 年对一名患有严重联合免疫缺陷症或 SCID 的 4 岁儿童进行首次成功的基因疗法——以及令人深感不安的低谷。临床试验参与者最终患上癌症和其他严重的健康并发症,甚至死亡。最大的问题似乎是将替换基因运送到需要去的地方的病毒。病毒是递送的明显选择:它们可以携带它们自己的 DNA 或 RNA 中的替换基因,并具有进入细胞的内置机制。但病毒并不总是能将基因带到正确的细胞中,可能会将其货物滑入 DNA 中的错误位置,并可能触发免疫系统引发致命炎症。
挑战和挫折,包括 1999 年一名叫杰西·盖尔辛格的十几岁男孩的死亡,几乎使基因疗法脱轨。但研究人员、公司和患者倡导团体坚持不懈。如今,研究人员正在寻找解决其交付困境的新方法。一些人正在开发更好的病毒或非病毒载体,而另一些人则使用新工具来修复或替换受损的基因。一种技术,到目前为止仅在小鼠身上进行过测试,依赖于与 COVID-19 疫苗中使用的技术类似的技术。
一些研究人员表示,对于各种遗传性疾病的基因疗法,前景从未如此光明。其他人对进展缓慢感到沮丧。
基因疗法的现状如何?
当科学家在 1989 年发现囊性纤维化症突变的基因时,基因疗法即将在人体临床试验中得到证实。“我们都在说,‘明年将进行基因治疗,’”约翰霍普金斯大学研究该疾病的遗传学家加里·卡廷说。
但这种预测并没有实现。研究人员在 2022 年发表在《药理学前沿》上的一篇论文中报道,至少有 36 项基因治疗试验涉及 600 多名囊性纤维化症患者,均未取得持久成功。
“问题出在哪里?问题一直是交付,”卡廷说。“你如何把它放在正确的地方?”
对于影响全球 160,000 多人的囊性纤维化症,正确的地方是肺部,其中 CFTR 基因的突变会导致粘稠粘液的积聚,从而难以呼吸。许多临床试验都试图将一个健康的基因拷贝滑入补充气道内衬的干细胞中。但病毒要穿过粘稠的粘液、经过巡逻的免疫细胞、穿过无关细胞的层并进入干细胞并不容易。“这是一个恶劣的环境。这是一个棘手的问题,”卡廷说。
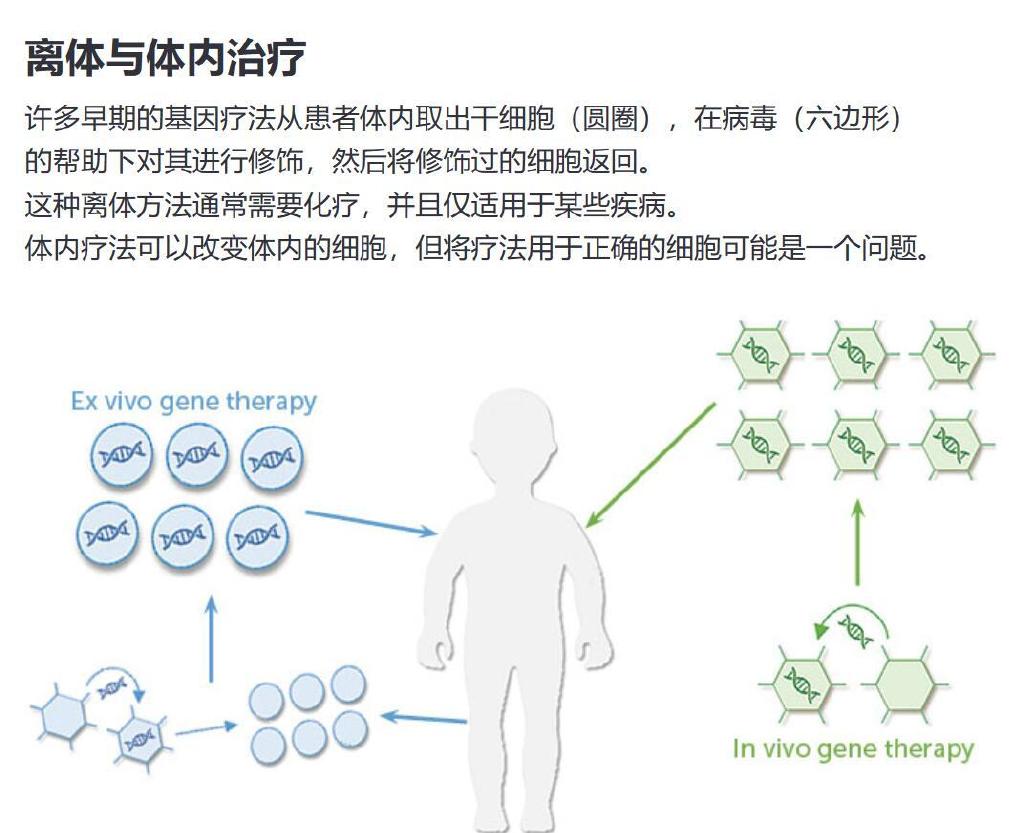
由于类似的斗争,许多最早获得批准的基因疗法反而会采集患者的造血干细胞,在实验室中培养和改造细胞,然后将改造后的细胞通常以骨髓移植的形式送回患者体内。这也是 CAR-T 细胞疗法治疗癌症所采用的方法。
在体外编辑细胞,或离体,已成功用于影响血液或免疫系统的罕见疾病。然而,它也存在局限性,因为科学家还没有找到从血液和骨髓以外的组织中提取干细胞并稍后替换它们的方法。它也伴随着它自己的危险。它通常需要化学疗法来杀死现有的骨髓,以便改造后的细胞能够扎根并复制。而将替换基因导入实验室细胞中的病毒仍然可能存在问题。
早期的基因疗法使用逆转录病毒,这些病毒通常在其活跃基因附近插入其 DNA 货物。一些在 1999 年和 2000 年接受基因治疗的患有遗传性疾病的儿童,这些疾病会使免疫系统丧失功能,当插入的基因增强了附近致癌基因的活性时,他们患上了白血病 (SN: 1/14/03; SN: 7/11/13)。
如今,大多数基因疗法依赖于经过改造的病毒,将它们的货物输送到更安全的地方,并减少免疫反应。但尽管如此,其履历远非完美。
例如,在 2022 年 9 月,总部位于马萨诸塞州索莫维尔的基因治疗公司 bluebird bio 获得了 FDA 批准,用于对患有罕见致命性神经退行性疾病脑肾上腺白质营养不良症的儿童进行离体慢病毒递送基因治疗。大约 1/4,000 到大约 1/50,000 的新生婴儿会患上脑肾上腺白质营养不良症,35% 到 40% 的患有这种疾病的男孩会发展为严重的形式,如果不进行治疗,通常会在五到十年内死亡。尽管在临床试验参与者中出现了三例骨髓增生异常综合征(一种癌症),但该疗法还是获得了批准。该公司确定慢病毒确实有错,名为 Skysona 的疗法带有癌症风险警告,并建议对 15 年进行年度癌症筛查。
研究人员在某些形式的失明 (SN: 5/24/21) 和一种称为脊髓性肌肉萎缩的退行性神经系统疾病方面取得了基因疗法的成功。威尔·昂格勒的基因疗法也依赖于体内方法。在这三种情况下,替代基因都是由腺相关病毒或 AAVs 递送的。这些病毒通常会将它们的货物投放到细胞核中,在那里它们与人的其余 DNA 分开。
但 AAV 的有效载荷大小有限,它们可能无法平等地感染所有细胞,并且它们可能引发危险和致命的免疫反应。接受 AAV 递送的基因疗法的患者还出现了肝脏损伤或衰竭以及可能导致器官损伤的微观血栓。
除了所有这些风险之外,一旦接受体内基因治疗的患者的免疫系统对递送病毒产生抗体和防御,重新给药变得困难或不可能。
2018 年 3 月 22 日,康涅狄格州里奇菲尔德的康纳·库伦,当时 7 岁,成为第一位接受辉瑞公司为杜氏肌肉营养不良症开发的实验性体内基因疗法的人。“在进行基因治疗之前,他真的很努力地爬楼梯,”康纳的父亲克里斯·库伦说。“基因治疗后两个月,他就跑上楼梯了。”
克里斯和他的妻子杰西卡是“战胜肌肉营养不良症的善良”的创始人,这是一个为肌肉营养不良症研究筹集资金的非营利组织,他们对康纳的力量和敏捷性的提高感到惊讶。克里斯说,这并不是患有杜氏肌肉营养不良症的孩子的正常情况。“这是一种进行性肌肉萎缩疾病……你永远不会好转。你只会越来越糟,而我们实际上看到他好转了。”
尽管这种改善持续了三到四年,但克里斯和杰西卡在去年观察到缓慢下降。“我们知道这并不一定是一种治愈方法,”克里斯说。他希望基因疗法仍然可以通过增强他们的心脏和膈肌肌肉来为康纳和其他男孩争取时间,但康纳可能需要另一剂基因疗法来防止他的骨骼肌恶化。
不幸的是,现在 13 岁的康纳体内含有高水平的抗体,对抗辉瑞版本的微肌营养不良蛋白进入他肌肉的 AAV。他将成为六名先前接受过基因治疗的儿童之一,他们将进入一项旨在降低其抗 AAV 抗体水平的临床试验。
随着 CRISPR 基因疗法的出现
即使病毒将其货物送达正确的细胞——正确的邮政编码——这并不意味着它会找到正确的地址。斯坦福大学医学院的医师科学家马修·波蒂厄斯说,即使是当今的病毒通常也不会将其基因递送到 DNA 中的正常位置。递送位置不是完全随机的,但也不是完全可以预测的。这有点像在旧海军订购一条裤子,然后到店取货。裤子会到达一家旧海军商店,但直到它们到达,你才会确切知道是哪一家。
波蒂厄斯说,对于某些基因,将它们放在基因组中的其他地方或让它们悬挂在染色体之外是可以的。其他基因必须在恰当的时间打开或以精确的量激活。当基因不在其天然栖息地时,这是很难做到的。波蒂厄斯说,1997 年他开始从事基因治疗工作时,让基因到达其正常位置绝非易事。
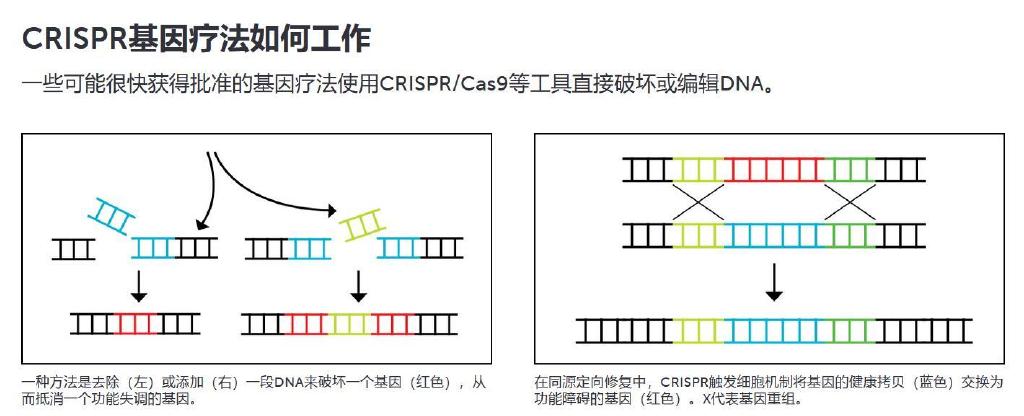
然后 CRISPR 基因编辑出现了。CRISPR 就像一把分子 GPS 导航的剪刀——通常是一种叫做 Cas9 的蛋白质——它会在精确的位置寻找并切割 DNA。自 2012 年首次亮相以来,研究人员一直在使用该工具在实验室培养皿中生长的和动物身上进行的实验中,在人类细胞中精确地切割、修复或插入基因(SN: 10/7/20)。
一些公司已开始在人体临床试验中使用基于 CRISPR 的基因疗法。其中几家公司从患者身上采集造血干细胞,在实验室中编辑这些细胞,然后通过骨髓移植将这些细胞输回患者体内。同样,将编辑后的细胞移植回患者体内首先需要进行化疗以杀死现有的骨髓,为工程细胞让路。但并非总是需要病毒将 CRISPR 剪刀和 GPS 定位器递送至要编辑的细胞。
总部位于波士顿的 Vertex Pharmaceuticals 正在与总部位于瑞士楚格的 CRISPR Therapeutics 合作,使用 CRISPR/Cas9 以一种能开启人类β地中海贫血或镰状细胞病患者胎儿血红蛋白的方式打断 DNA(SN: 8/14/19)。这两种情况都会破坏红细胞中的携氧血红蛋白。全球每年约有 60,000 名患者出生时即患有有症状的β地中海贫血,据估计,仅在美国,镰状细胞病就影响了约 100,000 人,黑人和西班牙裔患该病的可能性最高。
维多利亚·格雷是 2019 年第一位接受镰状细胞病疗法的人,3 月 6 日她在伦敦第三届人类基因编辑国际峰会上讲述了自己的经历。她说,当她的红细胞因血红蛋白有缺陷而塌陷成镰刀状并堵塞血管时,格雷会突然出现无法预测的剧烈疼痛。“我身体感受到的疼痛就像同时被闪电击中和被货运火车撞到。”她经常住院接受输血和阿片类止痛药,但这些药并不总是有效。2010 年 10 月,她经历了一次特别糟糕的发作。格雷是一位来自密西西比州的 37 岁四口之家母亲,她说直到第二年 1 月才离开医院。即便如此,她也不能自己吃饭或走路。
但在 2019 年 7 月 2 日,格雷得到了三瓶她自己的骨髓细胞,这些细胞经过编辑可产生胎儿血红蛋白。她说,最糟糕的部分是从化疗中恢复过来。“我花了大约七到八个月的时间才在身体上感觉良好并在精神上接受我感觉好多了,”她告诉在场的科学家、伦理学家和其他专家。多亏了她的“超级细胞”,她现在有一份全职工作,参加她孩子的足球比赛和啦啦队活动,还可以享受家庭郊游。“我曾经觉得自己只是存在于其中的生活,我现在正在蓬勃发展。”
6 月份公布的临床试验初步结果显示,27 名以前需要输血的 β 地中海贫血患者中,有 24 人在接受治疗后至少一年内不需要输血。在 17 名接受分析的镰状细胞病患者中,16 人在至少一年内没有发生疼痛危机。所有 17 人至少一年没有住院治疗。
这种方法和来自马萨诸塞州剑桥市的 Editas Medicine 的另一种镰状细胞疗法通过破坏一个基因来补偿另一个基因。斯坦福大学的波蒂厄斯反而有兴趣使用 CRISPR 来引入一个健康的替代基因。波蒂厄斯说,这种策略可能非常适合任何一个基因中的数千个突变都可能导致疾病的疾病。例如,对于囊性纤维化,已证明 CFTR 基因中的 719 种不同突变会导致该疾病。
该团队正在研究提高 CRISPR 剪刀切割的缺口通过插入该基因的健康拷贝而得到修复的机会的技术。这种复制粘贴方法(称为同源指导修复)很少奏效,但波蒂厄斯和他的同事正在改进它。在一项研究中,从镰状细胞病患者身上采集的细胞被编辑,然后移植到小鼠体内。他的团队在 2021 年的《科学转化医学》杂志上报道,多达 20% 的缺陷基因已被替换。
其他研究人员正在研究所谓的 CRISPR碱基编辑,以仅改变导致遗传疾病的错别字。该工具可以修复单个 DNA 字母突变,化学改变一个 DNA 碱基,即 DNA 分子的信息携带部分(SN: 10/25/17)。
在细胞返回体内之前,可以对其进行检查以确保安全。但研究人员也正试图将 CRISPR 编辑推向体内。然而,这些策略会带来对错位切割的担忧,这些切割会导致杂散突变,此外,有些策略可能仍然需要存在潜在风险的病毒递送。
2022 年 10 月,27 岁的特里·霍根在接受非营利组织“治愈罕见疾病”赞助的试验中接受 AAV 递送的杜氏肌肉营养不良症 CRISPR 基因疗法后死亡。霍根的死是由于对 AAV9 病毒高剂量的免疫反应,该病毒是将基因疗法输送到他的肌肉所需的。研究人员 9 月 28 日在新英格兰医学杂志上报道,这种免疫反应引发了细胞因子风暴,损害了他的肺部并导致他死亡。
病毒递送不是唯一的选择
约翰霍普金斯大学的遗传学家卡廷对用于体内疗法的非病毒递送载体寄予厚望。这些分子联邦快递卡车通常由脂质、蛋白质和化学物质组成,它们形成气泡,保护遗传货物并将其运输到需要去的地方。如果你接种了辉瑞或莫德纳的 COVID-19 疫苗,那么你体内已经注射了这种纳米颗粒——在这种情况下,携带信使 RNA。信使 RNA 或 mRNA 是 DNA 制造蛋白质指令的 RNA 副本。
研究人员已将纳米颗粒用于在不移除细胞的情况下编辑小鼠的造血干细胞。宾夕法尼亚大学佩雷尔曼医学院的药理学家兼生物技术专家哈米德·帕尔希兹说,这些纳米颗粒上镶嵌着抗体,这些抗体将它们靶向骨髓中的造血干细胞。研究人员还在实验室中编辑了携带镰状细胞突变的人类细胞。在那种情况下,mRNA 携带了制造 CRISPR 碱基编辑器的指令,该编辑器将镰状细胞突变转换为不会导致镰刀状的碱基。帕尔希兹和他的同事在 7 月 28 日的《科学》杂志上报道,高达 88% 的细胞被编辑,在通常会导致镰刀状的条件下,几乎没有出现月牙形。
“作为原理证明,本文基本上是在谈论[未来]的医学,”该论文的合著者、费城儿童医院的分子生物学家斯特凡诺·里维拉说。他预测,这种体内编辑——因为它无需采集干细胞和化疗——将比目前的基因疗法便宜得多,目前的基因疗法可能花费数百万美元。里维拉想象着将装满 mRNA 的纳米颗粒运送到非洲或其他许多镰状细胞病患者的地方。
成功是什么样子?
但那不是我们今天所处的境地。例如,想想 14 岁的安东尼奥·文托。他出生时患有营养不良性大疱性表皮松解症,这是由于产生胶原蛋白的基因突变引起的,该胶原蛋白有助于皮肤层保持在一起。安东尼奥和其他患有这种疾病的人在即使轻微的摩擦将他们皮肤的外层或粘膜从中间层撕裂开时,也会出现水疱和伤口。口腔和食道的瘢痕会使吞咽困难。
大面积的瘢痕也遮住了安东尼奥的视力。他在 2016 年和 2017 年对左眼进行了两次手术以去除瘢痕,但它们在两到三个月后又长回来了。这些手术一直失败,因此“我们决定不做任何额外的手术,”迈阿密大学健康系统巴斯康帕尔默眼科研究所和米勒医学院的眼科医生阿方索·萨巴特在 7 月 24 日的新闻发布会上说。似乎拯救安东尼奥的视力几乎没有希望。
但在 2020 年,作为一项临床试验的一部分,安东尼奥一直在使用匹兹堡 Krystal Biotech 开发的基因治疗凝胶来防止他的皮肤起泡。该疗法适用于皮肤,使用单纯疱疹病毒将胶原蛋白 COL7A1 基因输送到皮肤细胞。它于 5 月获得 FDA 批准。
萨巴特迫切地为他的病人寻找解决方案,他与 Krystal Biotech 合作,将基因疗法重新配制成可能对安东尼奥有效的滴眼液。滴眼液经过了两年的安全性和有效性测试。在那漫长的等待之后,去年,FDA 批准安东尼奥在同情用药的基础上使用滴眼液。
他是世界上唯一一个使用滴眼液的人,他在接受手术去除现有瘢痕后每周开始使用滴眼液。“很难说这种治疗方法仅通过一个病例就对这类患者有效,”萨巴特说。“但到目前为止,结果看起来很有希望。我们对未来感到非常兴奋,因为这种治疗方法绝对可能开辟新的可能性。”
安东尼奥一只眼睛的视力几乎完全恢复,另一只眼睛的视力恢复了约 60%,而且瘢痕没有复发。但由于效果是暂时的,他很可能需要数年内定期服药。
安东尼奥的情况凸显了基因疗法面临的一大挑战。波蒂厄斯说,就目前而言,这是一种精品疗法,而且价格昂贵。疾病的罕见性使得制药公司难以收回投资,因此一开始就不愿意投资。
Tr1X 是一家位于加州拉霍亚的生物技术公司,其联合创始人、总裁兼研发主管玛丽亚·格拉齐亚·龙卡罗指出,拥有这项技术还不够。
在 20 世纪 80 年代,龙卡罗帮助开创了一种针对“泡泡婴儿”的基因疗法,这些婴儿患有 SCID,这是由于编码腺苷脱氨酶的基因突变引起的,也称为 ADA-SCID。在米兰的圣拉斐尔远程医疗基因治疗研究所,龙卡罗和她的同事在 2002 年报道治愈了两名儿童。制药巨头 GSK 授权使用该疗法,名为 Strimvelis,并于 2016 年获得欧洲药品管理局的批准,可用于没有合适骨髓捐赠者的儿童。这是一个美丽的故事。当该产品在 2016 年获得批准时,我们用香槟庆祝,”龙卡罗说。
尽管获得了这一批准,但患者只能通过前往意大利进行同情用药治疗才能获得这种疗法。“GSK 决定停止投资罕见遗传疾病,因为他们认为这是一个不够大、不够盈利的市场,”龙卡罗说。总部位于伦敦的 Orchard Therapeutics 继承了该疗法,并于 2020 年宣布将减少对 ADA-SCID 的投资,以专注于不太罕见的疾病。她说,远程医疗研究所现在拥有该疗法的权利,并正在努力将其商业化。“你可以想象我和所有为将该产品推向市场做出贡献的人的挫败感。”
同样,欧洲药品管理局于 2019 年 3 月批准了 bluebird bio 的针对 β 地中海贫血症的基于 AAV 的基因疗法,但该公司于 2021 年从欧洲市场撤回了该产品。欧洲医疗保健系统正试图就该疗法与公司认为值得的价格进行谈判。
证明一种疗法是安全有效的只是一部分。“这些产品面临的真正挑战,”龙卡罗说,“是确保——尤其是对于罕见遗传疾病——它们在一个有动力和资源将其商业化的公司中找到一个家。”
安东尼奥·文托、威尔·昂格雷、维多利亚·格雷等人的故事表明,患者正在从今天的基因疗法中受益。过去几十年来,有很多进步的迹象。但即使最大的科学障碍消失了,在修复断裂的基因方面仍然存在许多障碍。
本文译自 sciencenews,由 BALI 编辑发布。

